KIT PER IL TEST RAPIDO DELL'ANTIGENE SARSCOV-2
Consentito acquisto per multipli di 25 pz - I tamponi saranno consegnati all'interno di confezioni da 25 pz.
USO PREVISTO
Questo prodotto è utilizzato per il rilevamento qualitativo in vitro del nuovo antigene del coronavlrus (SARS-CoV-2)In tamponi orofaringei nasali e nasofaringei umani.
Solo per uso professionale.
Il SARS-CoV-2 è un nuovo tipo di coronavirus denominato dall'Organizzazione Mondiale della Sanità. Il SARS-CoV-2 si è diffuso in tutto il mondo. Provoca polmonite virale con febbre, affaticamento, tosse secca e mal di gola come manifestazioni principali. I casi gravi di polmonite virale da essa causata si manifestano come dispnea, diminuzione della saturazione di ossigeno nel sangue e rapido sviluppo di sindrome da distress respiratorio acuto. shock settico ecc. Nei casi gravi, l'acidosi rnetabolica e la disfunzione della coagulazione sono difficili da trattare, che colpiscono direttamente vita e salute.
PRINCIPIO DI PROVA
Questo kit adotta il metodo sandtwich e il principio tecnico dell'immuoocromatografia con oro colloidale per determinare qualitativamente l'antigene SARS-CoV-2. Durante il test. il campione
viene fatto cadere nel pozzetto del campione e la cromatografia viene eseguita sotto l'effetto capillare. L'antigene SARS-CoV-2 nel campione si è combinato con l'anticorpo monoclonale I SARS-CoV-2 marcato con oro colloidale e quindi si è diffuso nell'area del test. Viene catturato da un altro anticorpo rivestito (anticorpo monoclonale II SARS-CoV-2) per formare un complesso e raccog1iersi nell'area del test (linea T). L'area di controllo della qualita è rivestita con l'anticorpo antitopo di capra e l'anticorpo marcatoc on oro colloidale viene catturato per formare un complesso e aggregato ne1l'area di controllo della qualità (linea C).Se la linea C non mostra il colore, indica che il risultato non è valido.
COMPONENTI PRINCIPALI
1. Reagente di prova: 1 test/busta.
2. Essiccante:1 pezzo/sacchetto, gel di silice.
3. Tampone: 1 per confezione.
4. Soluzione di trattamento del campione; 1 fiala/confezione.
5. Tappo del tubo: 1 pezzo/confezione
STOCCAGGIO E STABILITÀ
Il reagente del test viene conservato a 2-30, e il periodo di validità è provvisoriamente fissato a 18 mesi.
Vedere l'etichetta per la data di produzione e la data di scadenza.
REQUISITI DEL CAMPIONE
a) Tampone orofaringeo: la testa della persona è leggermente inclinata, con 1a bocca spalancata, che espone le tonsille faringee su entrambi i lati. Utilizzare il tampone per pulire delicatamente le tonsille su entrambi i lati per almeno 3 volte, quindi pulire la parete faringea posteriore su e giù almeno 3 volte.
b) Tampone nasale: Prima di prelevare il tampone nasale il paziente deve essere istruito a soffiarsi il naso. Inserire con cautela il campone nella narice e con la maggior secrezione sotto ispezione visiva. Usando una leggera rotazione, spingere il tampone fino a quando non si incontra resistenza a livello dei turbinati (meno di un pollice nell narice) e ruotare il tampone contro la parete nasale diverse volte, quindi rimuoverlo dalla narice.
e) Tampone rinofaringeo: inserire con cautela il tampone nella narice con la maggior secrezione sotto ispezione visiva . Tenere il tampone vicino al pavimento del seno nasale spingendo delicatamente il tampone nel rinofaringe posteriore. Ruotare più volie il tampone quindi rimuoverlo dal rinofaringe {in caso di tosse riflessa, fermarsi per 1 minuto).
PROCEDURA DI PROVA
Prima dell'uso leggere attentamente le istruzioni e operare in stretta conformità con le istruzioni:
a) portare la busta a temperatura ambiente prima dell'uso.
b) estrarre la cassetta, posizionarla su un tavolo orizzontale.
c) aggiungere 3 gocce del campione processato verticalmente nel pozzetto del campione e avviare il timer.
d) osservare il risultato dopo 10 minuti. Il risultato è valido entro 30 minuti.
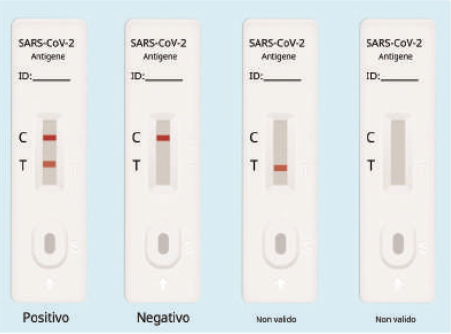
INTERPRETAZIONE DEI RISULTATI
1. Positivo: sia la linea di test (linea T) che la linea di controllo della qualità (linea C) appaiono a colori.
2. Negativo: la linea di prova (lineaT) non appare colorata, solo la linea di controllo di qualità (line C) appare colorata.
3. Non valido: la linea di controllo della qualità (linea C) non appare colorata, il che significa che il test non è valido e deve essere ripetuto.
LIMITAZIONI
a) Questo kit è un test qualitativo per la diagnosi in Vitro.
b) A causa di limltazioni metodologiche, la sensibilità di questo kit è inferiore a quella della PCR. Pertanto, dovrebbe essere prestata maggiore attenzione ai risultati negativi di questo esperimento e un giudizio completo dovrebbe essere combinato con altri risultati del test. Si raccomanda di integrare i risultati sospetti con il test dell'acido nucleico o l'isolamento del virus e la coltura in Vitro per la conferma.
c) Campionamento, trasporto e manipolazione irragionevoli o un basso contenuto di virus nel campione poreranno a risultati falsi negativi.
d) I risultati del test di questo reagente sono solo per riferimento clinico e non possono essere utilizzati come unica base per la diagnosi clinica. Il tester deve condurre ad una valutazione completa basata sulle manifestazioni cliniche del paziente e sui risultati di altri test di laboratorio.
e) La sostanza rilevata dal kit era la proteina nucleocapside SARS-COV-2 (NP). La variazione del nuovo mutante del coronavirus B.1.1.7 (SARS-CoV-2 VOC 202012/01) è principalmente nel dominio di legame del recettore della proteina spike (RBD). Non c'era affetto per la diagnosi dopo la mutazione. Quindi questo kit potrebbe essere utilizzato per rilevare il mutante SARS-Cov-2 ma NON potrebbe distinguere il mutante da SARS Cov-2.
PRESTAZIONE
1. Tasso di coincidenza positivo: 8 riferimenti positivi nazionali (P1-P8) diluiti a 1:10 per il test e i risultati dovrebbero essere tutti positivi.
2. Tasso di coincidenza negativo: 20 riferimenti nazionali (N1-N20) per i test, i risultati devono essere tutti negativi (i riferimenti negativi includono staphylococcus aureus, streptococcus pneumo niae, virus del morbillo, virus della parotite, adenovirus di tipo 3, mycoplasma pneumoniae,virus della parainftuenza di tipo 2, metapneumovirus, coronavirus OC43, coronavirus 229E, bacillus parapertussis, virus dell'influenza di tipo B victoria line, virus dtell'influenza di tipo B lineaY, virus dell'influenza di tipo AHlN1, virus dell'influenza di tipo A H3N2, virus dell'infuenza aviaria H7N9, virus dell'infuenza aviaria HSN1, virus di epstein-barr, enterovirus CA16, rinovirus, coronavirus HKU1, coronavirus NL63).
3. Limite di rilevamento: utilizzare il riferimento nazionale LOD S per diluire in tre campioni di 1:400 (S1), 1:800(S22) e 1:16000 (S3), ripetere la determinazione 3 volte, di cui S1 sono tutti positivi, S3 sono tutti negativi e i risultati S2 possono essere positivi o negativi.
Il LOD è stato determinato come la concentrazione di virus più bassa che è stata rilevata maggiore o uguale a 95% del tempo (cioè, concentrazione alla quale almeno 19 replicati su 20 sono risultati positivi).
Formato:
Confenzione con all'interno kit completo per 25 test rapidi
Le immagini dei prodotti sono puramente indicative e potrebbero pertanto non essere perfettamente rappresentative del packaging, delle caratteristiche del prodotto, differendo per colori, dimensioni o contenuto. Eventuali decorazioni, confezioni regalo e oggetti inseriti nelle immagini ai fini della presentazione del prodotto non saranno spediti negli ordini. Le denominazioni dei prodotti, gli ingredienti e le percentuali indicati nelle descrizioni sono puramente indicativi, potrebbero subire variazioni o aggiornamenti da parte delle aziende produttrici. Per l'impossibilità di adeguarsi in tempo reale a tali aggiornamenti, le foto e le informazioni tecniche dei prodotti inseriti su Farmaciarealefirenze.com possono differire da quelle riportate in etichetta o in altro modo diffuse dalle aziende produttrici. L'unico elemento di identificazione risulta essere il codice ministeriale MINSAN. La farmacia Farmaciarealefirenze.com non garantisce l'attualità delle informazioni pubblicate e declina ogni responsabilità in ordine ad eventuali errori, omissioni o mancati aggiornamenti delle stesse.